
في واسط.. الشوارع خالية والأسواق مغلقة..…
نشرت قبل 15 ساعة
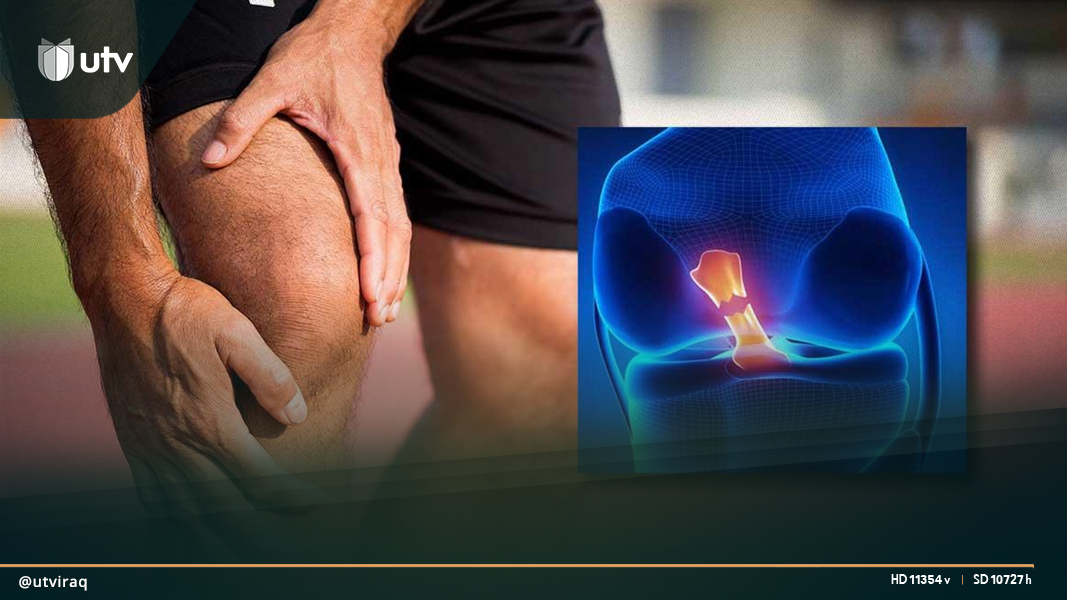
في عام 2019، كان نحو 530 مليون شخص حول العالم يعيشون مع التهاب المفاصل العظمي، وفقا لمنظمة الصحة العالمية. والتهاب المفاصل العظمي هو مرض تنكسي يتسبب بتآكل الأنسجة في المفاصل بمرور الوقت، وهو مشكلة صحية شائعة وأحد الأسباب الرئيسية للإعاقة.
ويمكن أن يتآكل الغضروف في المرضى الذين يعانون من التهاب المفاصل العظمي الشديد، لدرجة أن المفاصل تتحول إلى عظم على عظم بدون وسادة بينهما. وهذا ليس مؤلما بشكل لا يصدق فحسب، بل لا يمكن للمفاصل في ضوئه أن تؤدي وظائفها بشكل صحيح. وفي هذه المرحلة يكون العلاج الفعال الوحيد هو جراحة استبدال المفصل، وهي مكلفة ومؤلمة.
وفي تشرين الثاني 2021، قدم باحثو جامعة نورث وسترن علاجا جديدا قابلا للحقن يَستخدم “الجزيئات الراقصة” السريعة الحركة لإصلاح الأنسجة وعكس الشلل بعد الإصابات الحادة في الحبل الشوكي.
والآن طبق الفريق البحثي نفسه في دراسة جديدة الإستراتيجية العلاجية على خلايا غضروفية بشرية تالفة، وفعّل العلاج تعبير الجينات الضرورية لتجديد الغضروف في غضون أربع ساعات فقط. وبعد ثلاثة أيام، أنتجت الخلايا البشرية مكونات البروتين اللازمة لتجديد الغضروف.
كما وجد الباحثون أنه مع زيادة حركة الجزيئات زادت فعالية العلاج، وبمعنى آخر كانت حركات الجزيئات حاسمة في تحفيز عملية نمو الغضروف، كما أظهرت نتائج الدراسة التي نُشرت في 26 يوليو/تموز الجاري بمجلة الجمعية الكيميائية الأميركية.
ووفقا لموقع يوريك أليرت، يقول قائد الدراسة صمويل آي ستوب الأستاذ بجامعة نورث وسترن والمتخصص في الطب النانوي التجديدي ومدير مؤسس لمعهد سيمبسون كويري للتكنولوجيا الحيوية النانوية ومركزه التابع مركز الطب النانوي التجديدي: “العلاجات الحالية تهدف إلى إبطاء تقدم المرض أو تأجيل الاستبدال الذي لا مفر منه، ولا توجد خيارات تجديدية لأن البشر لا يملكون القدرة الفطرية على تجديد الغضروف في مرحلة البلوغ”.
ويضيف: “عندما لاحظنا لأول مرة التأثيرات العلاجية للجزيئات الراقصة، لم نجد أي سبب يجعلها تنطبق فقط على الحبل الشوكي. الآن نلاحظ التأثيرات في نوعين من الخلايا غير مرتبطين تماما ببعضهما البعض؛ خلايا الغضروف في مفاصلنا، والخلايا العصبية في الدماغ والحبل الشوكي. هذا يجعلني أكثر ثقة بأننا اكتشفنا ظاهرة شاملة قد تنطبق على العديد من الأنسجة الأخرى”.
افترض ستوب وفريقه أن “الجزيئات الراقصة” قد تشجع الأنسجة العنيدة على التجديد، والجزيئات الراقصة هي تراكيب تتكون من ألياف نانوية اصطناعية تحتوي على عشرات إلى مئات الآلاف من الجزيئات التي تحمل إشارات قوية للخلايا. ومن خلال ضبط حركاتها الجماعية عبر هيكلها الكيميائي، اكتشف ستوب أن الجزيئات المتحركة يمكنها بسرعة العثور على المستقبِلات الخلوية والتفاعل معها بشكل صحيح، والتي تكون أيضا في حركة مستمرة ومكتظة للغاية على أغشية الخلايا.
وتحاكي الألياف النانوية المصفوفة خارج الخلية بمجرد دخولها الجسم الأنسجة المحيطة بها. ومن خلال مطابقة هيكل المصفوفة ومحاكاة حركة الجزيئات البيولوجية ودمج الإشارات الحيوية للمستقبلات، تستطيع المواد الاصطناعية التواصل مع الخلايا.
يقول ستوب: “المستقبلات الخلوية تتحرك باستمرار من خلال جعل جزيئاتنا تتحرك، “ترقص”، أو حتى تقفز مؤقتا خارج هذه التراكيب المعروفة بالبوليمرات الفائقة الجزيئية، ويمكنها الاتصال بشكل أكثر فعالية مع المستقبلات”.

نشرت قبل 15 ساعة

نشرت قبل 15 ساعة

نشرت قبل 15 ساعة

نشرت قبل 22 ساعة

نشرت قبل 23 ساعة

نشرت قبل 23 ساعة

نشرت قبل 23 ساعة

نشرت قبل 23 ساعة

نشرت قبل 23 ساعة

نشرت قبل 23 ساعة

نشرت قبل 23 ساعة

نشرت قبل 23 ساعة